بررسی سمیت سلولی
14 مهر 1402 1402-07-15 14:43بررسی سمیت سلولی
بررسی سمیت سلولی
سمیت سلولی چیست؟
اندازه گیری اثرات نامطلوب بالقوه یک ماده بر یک ارگانیسم برای علم پزشکی و چندین صنعت حیاتی است. یکی از خواص یک ماده که باید شناخته شود، اثر سیتوتوکسیک آن است. این مقاله در مورد این موضوع بحث خواهد کرد.
تفاوت بین سمیت سلولی و سمیت
بسیاری از مواد اثر سمی دارند. برخی از آنها سمی تر از دیگران هستند، و بسیار حیاتی است که دانشمندان و متخصصان پزشکی از اثرات آن و میزان تاثیر شدید آنها بر یک ارگانیسم اطلاع داشته باشند. سمیت به عنوان کیفیت سمی یا سمی بودن یک ماده (مثلاً یک دارو) تعریف می شود. سمیت بستگی به دوز دارد.
در حالی که سمیت یک اصطلاح کلی تر برای مضر بودن یک ماده برای ارگانیسم است. سمیت سلولی اصطلاحی است برای سمی بودن یک ماده برای سلول ها. یک ترکیب سیتوتوکسیک می تواند از طریق نکروز یا آپوپتوز باعث آسیب یا مرگ سلولی شود. برخی از مواد سمیت سلولی بیشتری نسبت به سایرین دارند و هدف محققان اندازه گیری سطح سمیت سلولی یک ماده شیمیایی برای اطمینان از اینکه برای بیماران مضر و/یا کشنده نیست، هستند. نمونه هایی از عوامل سیتوتوکسیک شامل داروهای شیمی درمانی و سموم خاص است.
اندازه گیری سمیت سلولی
در حالی که سمیت سلولی را می توان به روش های مختلفی اندازه گیری کرد، رایج ترین روش ها اندازه گیری محتوای ATP، استفاده از نشانگرهای پروتئاز یا استفاده از رنگ های حیاتی مانند رنگ های فورمازان است. بیشتر سنجشهای سیتوتوکسیک بر این فرض کار میکنند که یک سلول در حال مرگ دارای غشای سلولی آسیبدیده است که منجر به نشت اجزای سلولی به محیط اطراف میشود. غشاهای سلولی آسیب دیده همچنین اجازه نفوذ رنگ ها را به خود سلول می دهند. سپس این پدیده ها می توانند توسط محققان اندازه گیری و تجزیه و تحلیل شوند.
با این حال، فعالیت سیتوتوکسیک را می توان دست کم گرفت. این به این دلیل است که از بین رفتن یکپارچگی غشا بعداً در فرآیند سیتوتوکسیک رخ می دهد. برای جلوگیری از این امر، اخیراً سنجشهای زیستی غیر رادیواکتیو جایگزین توسعه یافتهاند. اینها سمیت سلولی را در نمونه های جمعیت سلولی در حال تکثیر و غیر تکثیر اندازه گیری می کنند. اندازهگیری ترکیباتی که از سلولهای آسیبدیده نشت میکنند ، امکان شناسایی آن سلولها را در میان سلولهای سالم و زنده فراهم میکند.
دو دسته از مولکولها وجود دارند که میتوانند در یک سنجش زیستی سمیت سلولی استفاده شوند. دسته اول رنگهای حیاتی مانند تریپان بلو یا رنگهای فلورسنت متصل شونده به DNA هستند – این رنگها معمولاً نمیتوانند وارد سلولهای زنده شوند، اما میتوانند از غشای سلولی آسیبدیده عبور کنند. دسته دوم نشانگرهای سلولی هستند که از یک سلول آسیب دیده به بیرون نشت می کنند. اینها می توانند به طور مصنوعی معرفی شوند یا می توانند مولکول های طبیعی موجود مانند آنزیم ها باشند.
دانستن تعداد سلول زنده یا مرده هم در طول آزمایش و هم بعد از آن بسیار حیاتی است. علاوه بر این، اندازه گیری تعداد سلول های مرده انباشته شده در طول آزمایش نیز مفید است و همچنین تمایز بین سمیت سلولی و توقف رشد نیز مفید است. تخمین تعداد سلول های مرده انباشته شده می تواند حساس تر از اندازه گیری کاهش در یک نشانگر باشد.
سمیت سلولی و شیمی درمانی
یکی از زمینه هایی که اندازه گیری سمیت سلولی در آن نقش دارد، تحقیقات سرطان و داروهای شیمی درمانی است. دانستن اثرات سیتوتوکسیک یک دارو بر سلول سرطانی و هرگونه اثرات ناخواسته بر سلول های سالم و طبیعی بسیار حیاتی است. به عنوان مثال، برخی از داروهای مورد استفاده در شیمی درمانی تراتوژن هستند و باعث نقص عملکردی و فیزیکی در جنین یا جنین می شوند.
شیمی درمانی می تواند با هدف درمان یا افزایش طول عمر انجام شود و همچنین می توان از آن برای تسکین علائم استفاده کرد. شیمی درمانی به طور فزاینده ای همراه با رادیوتراپی و جراحی استفاده می شود. این می تواند برای کاهش اندازه تومور یا به عنوان درمان کمکی باشد. تمام داروهای سیتوتوکسیک دارای عوارض جانبی هستند و باید بین سمیت و فایده برای بیمار تعادل برقرار شود.
ترکیبی از داروها در برخی از درمان های سرطان استفاده می شود. این کوکتل ها معمولاً بیشتر از داروهای منفرد سیتوتوکسیک هستند، اما مزیت درمان بهتر تومورها و افزایش بقای بیمار را دارند. با این حال، برای برخی از تومورها، درمان با داروهای منفرد بهترین گزینه باقی می ماند.
کلاس های مختلفی از داروهای سیتوتوکسیک وجود دارد. هر کدام دارای فعالیت ضد توموری، سمیت و مکانهای اثر مشخصی هستند. یکی از عوامل کلیدی که باید قبل از انتخاب یک داروی خاص در نظر گرفته شود، مکان های متابولیسم و دفع است، زیرا ممکن است منجر به افزایش سمیت ناشی از اختلال در حمل و نقل دارو شود. دوز نیز برای جلوگیری از هر گونه عوارض جانبی نامطلوب که ممکن است رخ دهد مهم است.
سمیت سلولی و نانوذرات
نانوتکنولوژی یک رشته هیجان انگیز و اخیراً توسعه یافته است. در حالی که تعداد نانوذرات و نانومواد و کاربردهای آنها در چند دهه گذشته به طور تصاعدی افزایش یافته است، تحقیقات در مورد اثرات بلندمدت آنها بر بدن انسان روی زمین نسبتاً نازک است. این شامل پتانسیل آنها برای سمیت سلولی است. استفاده روزافزون از نانوذرات در ابزارهای تشخیصی و درمانی است.
خواص فیزیکوشیمیایی نانوذرات متفاوت می تواند اثرات سیتوتوکسیک ناخواسته ای بر بدن داشته باشد. فقط استفاده از آنها در پزشکی نیست که به این معنی است که اثرات سیتوتوکسیک آنها باید شناخته شود. آنها همچنین در محیط زیست به عنوان یک پیامد ناخواسته تحقیقات و فعالیت های صنعتی یافت می شوند.
نانوذرات می توانند از راه های مختلفی از جمله بلع، جذب، کاشت و تزریق وارد بدن شوند. هنگامی که وارد بدن می شوند، اثرات بالقوه سیتوتوکسیک آنها شامل جذب خود به خودی پروتئین ها، تعامل با غشای سلولی، DNA، لیپیدها و پروتئین ها است. اینها می توانند اثرات زیستی مختلفی مانند آپوپتوز، اختلال غشای سلولی، التهاب و استرس اکسیداتیو را ایجاد کنند. آگاهی از میزان سیتوتوکسیک بودن آنها حیاتی است زیرا آنها در هر صنعتی بیشتر مورد استفاده قرار می گیرند.
در نتیجه
با پیشرفت صنعت علوم پزشکی، موادی مانند مواد شیمیایی صنعتی، داروها و نانوذرات به طور مداوم در بازار منتشر می شوند. همه این مواد و ترکیبات دارای اثرات سیتوتوکسیک بالقوه ناشناخته هستند و اندازه گیری آنها برای اطمینان از ایمن بودن آنها برای استفاده انسان بسیار مهم است. سمیت سلولی یک عامل کلیدی در تعیین عوارض جانبی نامطلوب و تبدیل جهان به مکانی امنتر است.
سمیت سلولی موضوع بسیار مهمی است که آزمایشهای RNAi از روش تحویلی استفاده کنند که منجر به سمیت سلولی بسیار کمی شود. سمیت سلولی می تواند نتایج را به چند روش مختلف تحت تاثیر قرار دهد:
- “سوگیری خاموش کردن” به دلیل سمیت: اگر سلول ها در معرض سطوح سمی یک ماده قرار گیرند، ممکن است لیز شوند و بمیرند. این می تواند تأثیر زیادی بر داده های نقطه پایانی داشته باشد. مگر اینکه کنترل های مناسبی اجرا شود، چیزی که به نظر می رسد خاموش کردن خوب است در واقع می تواند مرگ سلولی باشد. علاوه بر این، مرگ سلولی میزان سیگنال کل از یک کشت را کاهش می دهد و داده ها را قوی تر می کند
- بازداشت ترجمه: سلول ها می توانند دچار توقف ترجمه شوند، به این معنی که متابولیسم را کند می کنند به طوری که پروتئین های بسیار کمی ترجمه می شوند. اگر سلول ها در معرض غلظت سمی یک ماده (یا dsRNA طولانی) قرار گیرند، این اتفاق می افتد.
مسمومیت به بهترین وجه توسط پرورش دهندگان بافت با استفاده از نشانه های بصری ارزیابی می شود. تغییرات مورفولوژیکی، تغییرات در رشد و شکاف در تراکم کشت، نشانه هایی هستند که نشان می دهد یک کشت در معرض غلظت سمی یک ماده قرار گرفته است. تصاویر زیر نمونه هایی از کشت های در معرض غلظت های کم، متوسط و زیاد یک ماده سمی را ارائه می دهند. سطوح مختلف سمیت را می توان با تجزیه و تحلیل بصری سلول ها در کشت تعریف کرد. همانطور که سلول ها در معرض غلظت های بالاتر یک ماده سمی قرار می گیرند، مورفولوژی آنها تغییر می کند A))، سلول های مستطیلی شکل به(B) ، وسلولهای اشکال گرد( C). همانطور که سلول ها به گرد شدن ادامه می دهند، در نهایت از صفحه جدا می شوند یا لیز می شوند و می میرند.

راندمان بالای تحویل siRNA با سمیت کم
siLentFect™ در انتقال سیتوپلاسمی siRNA بسیار مؤثر است. در هر ترانسفکشن به حجم بسیار کمی از لیپید نیاز است که هزینه هر آزمایش ناک داون را کاهش می دهد.
دو ویژگی silentFect در زیر نشان داده شده است. اول، کارایی بالا با استفاده از غلظت های بسیار کم siLentFect برای دستیابی به شکست کافی (محدوده ایده آل 0.75 تا 2 میکرولیتر در یک صفحه 24 چاهی) نشان داده می شود. دوم، سمیت کم با مشاهده بیان β-گالاکتوزیداز siRNA کنترل غیراختصاصی (نشان داده شده به رنگ نارنجی)، که با کنترل ترانسفکت نشده سازگار بود نشان داده می شود. با افزایش غلظت siLentFect، سلامت کشت حفظ می شود، که نشان می دهد siLentFect در غلظت های بهینه حداقل سمی است.

حذف β-گالاکتوزیداز با استفاده از siLentFect و anti-β-gal siRNA.سلول های پایدار CHO-lacZ با استفاده از سیستم Gene Pulser Xcell™ تولید و در صفحات 24 چاهی کاشته شدند. سپس سلول ها با 10 نانومولار anti-β-gal siRNA (آبی) یا یک siRNA کنترل غیراختصاصی (نارنجی) با استفاده از مقادیر فزاینده siLentFect ترانسفکت شدند. پس از 24 ساعت، سلول ها برای فعالیت β-gal مورد سنجش قرار گرفتند.
توجه داشته باشید:β-گالاکتوزیداز یک مدل خوب است زیرا رنگآمیزی x-gal بصری برای سنجش کیفی و سنجش ONPG برای آنالیزهای کمی میتواند انجام شود. با این حال، پروتئین β-گالاکتوزیداز بسیار پایدار است، بنابراین سنجشهای ONPG برای حذف 24 ساعت پس از ترانسفکشن به عنوان نماینده کاهش مقادیر رونوشت نیستند. نتایج Knockdown با حضور پروتئینی که قبل از تحویل siRNA بیان شده بود، سوگیری میکند، اما در زمان سنجش در سلول باقی میماند. این امر اهمیت مشخصه یابی قبلی پایداری پروتئین را هنگام استفاده از qPCR برای تجزیه و تحلیل RNAi توضیح می دهد. ناک داون ممکن است 99 درصد رونوشت پس از 24 ساعت باشد، اما پایداری پروتئین ممکن است نتایج سنجش فنوتیپی را تغییر دهد.
سوگیری خاموش کردن به دلیل سمیت
قرار گرفتن در معرض سطوح سمی یک ماده می تواند باعث لیز شدن سلول ها و مرگ آنها شود. این می تواند تأثیر قابل توجهی در ارزیابی داده های نقطه پایانی داشته باشد. در غیاب کنترل های مناسب، کاهش بیان ممکن است نشان دهنده خاموشی خوب باشد، اما در واقع می تواند به دلیل مرگ سلولی باشد. علاوه بر این، مرگ سلولی میزان سیگنال کل از یک کشت را کاهش می دهد و داده ها را قوی تر می کند.
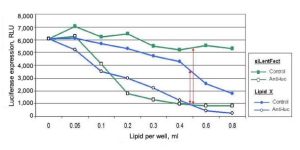
این نمودار اثرات افزایش غلظت دو لیپید، siLentFect و یک لیپید دیگر (Lipid X) را نشان می دهد. آثار لیپیدی “ضد لوک” کاهش لوسیفراز را در سلول های CHO نشان می دهد که به طور پایدار برای بیان لوسیفراز ترانسفکت شده اند. با این حال، کنترل (بدون شکست) برای لیپید X نشان می دهد که با افزایش غلظت لیپید، بیان لوسیفراز کاهش می یابد. این به احتمال زیاد به دلیل استرس سلولی یا مرگ سلولی است. siLentFect حداقل سمیت را نشان می دهد همانطور که تنها با کاهش جزئی بیان برای نمونه کنترل نشان داده شده است.
تاثیر سمیت بر بهینه سازی
سمیت لیپید می تواند بر میزان بهینه سازی که می تواند انجام شود تأثیر بگذارد. اگر لیپید قبل از ایجاد اثرات سمی دارای یک پنجره عملکرد کوچک باشد، پروتکل محدود است. siLentFect دامنه عملکردی وسیعی دارد که تا حدی به دلیل سمیت کم آن است که امکان بهینهسازی پروتکل بیشتری را برای سازگاری با انواع خطوط سلولی فراهم میکند. نمودارهای زیر محدوده عملکردی siLentFect را در مقایسه با لیپیدهای موجود دیگر نشان می دهد.
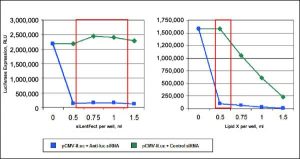
سلول های COS-7 در صفحات 24 چاهی کاشته شدند و با 0.5 میکروگرم از یک ناقل بیان ژن گزارشگر لوسیفراز (pCMViLuc) و 10 نانومولار از هر یک از یک siRNA ضد لوسیفراز ترانسفکت شدند(.-) یا یک کنترل siRNA غیر اختصاصی (-) با استفاده از حجم های مختلف معرف siLentFect و یک لیپید دیگر (Lipid X). فعالیت لوسیفراز 24 ساعت پس از ترانسفکشن اندازه گیری شد. ردپاهای “ضد لوک” (آبی) با استفاده از هر دو لیپید کاهش عالی لوسیفراز را نشان می دهند، با این حال نمونه های کنترل (سبز) نتایج به طور چشمگیری متفاوت نشان می دهند. نمونه کنترل siLentFect ثابت می ماند که نشان دهنده زنده ماندن سلولی و سمیت بسیار کم است. در قرارداد، نمونه کنترل لیپید X کاهش قابل توجهی در بیان نشان می دهد که احتمالاً به دلیل مرگ سلولی در اثر سمیت بالا است.
آزمایش سیتوتوکسیسیته دارویی
آزمایش سمیت سلولی می تواند به عنوان یک ابزار غربالگری برای داروها قبل از انجام آزمایش های سم شناسی گسترده تر مفید باشد. علاوه بر این، آزمایش سمیت سلولی می تواند برای اهداف کنترل کیفیت برای آزمایش آزادسازی مقدار زیادی مواد خام یا محصولات دارویی تولید شده استفاده شود.
تست های سمیت سلولی برای تعیین سمیت سلولی ترکیبات به صورت کیفی یا کمی طراحی شده اند. تستهای سمیت سلولی کیفی ارائهشده توسط Pacific BioLabs عبارتند از: آزمایش تماس مستقیم، آزمایش انتشار تماس غیرمستقیم آگار و آزمایش Elution MEM. علاوه بر این، Pacific BioLabs یک تست سمیت سلولی کمی بسیار حساس به نام MTT Assay ارائه می دهد.
استانداردهای دنبال شده
- USP <87>
- ISO 10993-5
تست های سیتوتوکسیسیته موجود
تماس مستقیم
روش تماس مستقیم از فیبروبلاستهای موش L-929 استفاده میکند که به کف ظرف پتری یا بشقاب میچسبند. سلولها تا سطح زیرهمراهی رشد میکنند (تقریباً 80 درصد همریزی) و مقاله آزمایشی مستقیماً روی سلولها قرار میگیرد. برای مایعات و عصاره ها، یک تکه کاغذ صافی استریل با نمونه آزمایش اشباع شده و کاغذ صافی مستقیماً روی سلول ها قرار می گیرد. سلول ها و مقاله آزمایشی با هم انکوبه می شوند و پس از 24 ساعت نمونه ها در میکروسکوپ کنتراست فاز معکوس بررسی می شوند. به سلول ها درجه ای از 0 تا 4 داده می شود که مربوط به عدم واکنش به واکنش شدید است.
این آزمایش برای مواد با چگالی بسیار کم یا بسیار بالا توصیه نمی شود. مواد با چگالی بسیار کم در محیط رشد سلولی شناور می شوند و مواد با چگالی بسیار بالا این پتانسیل را دارند که وقتی نمونه روی آنها قرار می گیرد به سلول ها آسیب برساند. برای مواد با چگالی کم و بالا، روش پوشش آگارز (انتشار آگارز) ترجیح داده می شود.
روکش آگارز (انتشار آگار)
پوشش آگارز (که به آن انتشار آگار نیز گفته می شود) مشابه روش تماس مستقیم است که در بالا توضیح داده شد با این تفاوت که در آن از آگار استفاده می شود. آگار را روی سلول ها می ریزند و می گذارند تا جامد شود. سپس نمونه آزمایشی روی آگار قرار می گیرد. آگار یک “بالشتک” ایجاد می کند که از سلول ها در برابر مواد متراکم محافظت می کند و همچنین از شناور شدن مواد با چگالی کم در محیط رشد جلوگیری می کند. سلول ها، آگار و نمونه آزمایشی به مدت بیش از 24 ساعت انکوبه می شوند و سپس در زیر میکروسکوپ بررسی می شوند تا شدت سمیت برای سلول ها بر اساس طرح درجه بندی 0-4 مشخص شود.
MEM ELUTION
برخلاف روشهای انتشار آگارز و تماس مستقیم، روش شستشوی MEM شامل استفاده از مواد قابل استخراج و شستهشوی از مقاله آزمایشی به سلولها است. مقاله آزمایشی با مایعی به نام وسیله نقلیه استخراج انکوبه می شود. پس از استخراج، عصاره مقاله آزمایشی به فیبروبلاست های موش L-929 اضافه می شود. اثرات سیتوتوکسیک عصاره پس از یک دوره انکوباسیون 48 ساعته مشخص می شود. امتیازدهی بر اساس شرایط سلول ها با استفاده از سیستم درجه بندی 0 تا 4 است که با تأثیر سیتوتوکسیک مشاهده شده مرتبط است.
سنجش MTT
سنجش MTT یک سنجش سمیت سلولی کمی است که از رنگی به نام 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (به اختصار MTT) استفاده می کند. MTT یک ماده شیمیایی محلول در آب زرد رنگ است که توسط سوکسینات دهیدروژناز میتوکندری شکسته می شود و فرمازان به رنگ بنفش تشکیل می شود. این واکنش فقط در سلول های زنده سالم رخ می دهد. اگر سلول مرده باشد، سوکسینات دهیدروژناز میتوکندری MTT را نمی شکافد.
سنجش MTT با استفاده از عصاره مقاله آزمایشی انجام می شود. عصاره به فیبروبلاست های موش L-929 در چهار غلظت مختلف، رقیق نشده، 1:2، 1:4 و 1:10 اضافه می شود. پس از 24 ساعت، MTT به سلول ها اضافه می شود و وجود فرمازان بنفش را می توان با استفاده از صفحه خوان آنالیز کرد. برای تعیین درصد سلول های زنده، نمونه ها با گروه شاهد مقایسه می شوند.
منابع
- با سپاس و قدردانی فراوان از مجموعه زیست ژن بافت